- 1.1.1.1 理想气体状态方程与分压定律(Av44506930,P1)
- 2.1.1.2 实际气体(Av44506930,P2)
- 3.1.2 等离子体(Av44506930,P3)
- 4.2.1.1 系统与环境(Av44506930,P4)
- 5.2.1.2 聚集状态与相(Av44506930,P5)
- 6.2.1.3 系统状态与状态函数(Av44506930,P6)
- 7.2.1.4 过程与途径(Av44506930,P7)
- 8.2.1.5 热和功(Av44506930,P8)
- 9.2.1.6 热力学能(Av44506930,P9)
- 10.2.2.1 反应热(Av44506930,P10)
- 11.2.2.2 热力学标准态(Av44506930,P11)
- 12.2.2.3 热化学方程式(Av44506930,P12)
- 13.2.2.4 Hess定律(Av44506930,P13)
- 14.2.2.5 物质的标准摩尔生成焓(Av44506930,P14)
- 15.2.2.6 利用物质的标准摩尔生成焓计算反应热(Av44506930,P15)
- 16.2.2.7 标准摩尔燃烧焓、用标准摩尔燃烧焓计算反应热(Av44506930,P16)
- 17.2.3.1 化学反应的自发过程(Av44506930,P17)
- 18.2.3.2 影响化学反应方向的因素-焓变(Av44506930,P18)
- 19.2.3.3 影响化学反应方向的因素-熵变、温度(Av44506930,P19)
- 20.2.3.4 化学反应的吉布斯自由能变--化学反应方向的判据(Av44506930,P20)
- 21.2.3.5 化学反应的标准摩尔吉布斯自由能变的计算(Av44506930,P21)
- 22.2.3.6 用反应的标准摩尔焓变和标准摩尔熵变算反应自发的温度(Av44506930,P22)
- 23.2.4.1 化学反应的限度--化学平衡(Av44506930,P23)
- 24.3.1 化学反应速率及其表示方法(Av44506930,P24)
- 25.3.2.1 浓度与反应速率(一)(Av44506930,P25)
- 26.3.2.2 浓度与反应速率(二)(Av44506930,P26)
- 27.3.3 温度对反应速率的影响(Av44506930,P27)
- 28.3.4 反应的活化能(Av44506930,P28)
- 29.3.2.5 催化剂与反应速率(Av44506930,P29)
- 30.4.1 分散系统和溶液(Av44506930,P30)
- 31.4.2.1 稀溶液的蒸气压下降(Av44506930,P31)
- 32.4.2.2 稀溶液的沸点升高和凝固点降低(Av44506930,P32)
- 33.4.2.3 稀溶液的渗透压(Av44506930,P33)
- 34.4.2.4 依数性理论的局限(Av44506930,P34)
- 35.4.3.1 弱电解质的解离平衡(Av44506930,P35)
- 36.4.3.2 共同离子效应(Av44506930,P36)
- 37.4.3.3 缓冲溶液(Av44506930,P37)
- 38.4.4.1 溶度积和溶解度(Av44506930,P38)
- 39.4.4.2 溶度积规则(Av44506930,P39)
- 40.4.4.3 多相离子平衡的移动(Av44506930,P40)
- 41.4.5 表面活性剂(Av44506930,P41)
- 42.5.4.3 电极上放电反应的一般规律(Av44506930,P42)
- 43.6.1.1 早期的原子结构模型(Av44506930,P43)
- 44.6.1.2 玻尔的氢原子理论(Av44506930,P44)
- 45.6.2.1 微观粒子的运动特征(Av44506930,P45)
- 46.6.2.2 主量子数和角量子数(Av44506930,P46)
- 47.6.2.3 磁量子数和自旋量子数(Av44506930,P47)
- 48.6.2.4 波函数的图形描述(Av44506930,P48)
- 49.6.2.5 电子云的角度分布图(Av44506930,P49)
- 50.6.2.6 电子云的径向分布图(Av44506930,P50)
- 51.6.3.1 多电子原子轨道能级(Av44506930,P51)
- 52.6.3.2 屏蔽效应和钻穿效应(Av44506930,P52)
- 53.6.3.3 核外电子排布规则(Av44506930,P53)
- 54.6.3.4 :原子的电子层结构和元素周期表(Av44506930,P54)
- 55.6.3.5 原子半径的周期性(Av44506930,P55)
- 56.6.3.6 电离能和电子亲和能的周期性变化(Av44506930,P56)
- 57.6.3.7 电负性的周期性(Av44506930,P57)
- 58.6.4.1 化学键的电子理论(Av44506930,P58)
- 59.6.4.2 现代价健理论(Av44506930,P59)
- 60.6.4.3 共价键的类型(Av44506930,P60)
- 61.6.4.4 杂化轨道理论(Av44506930,P61)
- 62.6.4.5 sp和sp2杂化(Av44506930,P62)
- 63.7.1 过渡元素的通性(Av44506930,P63)
- 64.7.2.1 铬族元素的概述(Av44506930,P64)
- 65.7.2.2 铬的重要化合物(一)(Av44506930,P65)
- 66.7.2.3 铬的重要化合物(二)(Av44506930,P66)
- 67.7.3 锰族元素及其化合物(Av44506930,P67)
- 68.8.1.1 配合物的组成和基本概念(Av44506930,P68)
- 69.8.1.2 配位数的影响因素与命名(Av44506930,P69)
- 70.8.2.1 配合物的价键理论与配离子的空间构型(一)(Av44506930,P70)
- 71.8.2.2 配合物的价键理论与配离子的空间构型(二)(Av44506930,P71)
- 72.8.3 配离子的解离平衡(Av44506930,P72)
- 73.8.4 几种类型的配合物(Av44506930,P73)
- 74.8.5 配合物的应用(Av44506930,P74)
- 75.9.1 材料的分类及常用工程材料在周期系中的分布(Av44506930,P75)
- 76.9.2 形状记忆合金与贮氢合金(Av44506930,P76)
- 77.9.3 精细陶瓷与纳米陶瓷(Av44506930,P77)
- 78.9.4 有机高分子材料(Av44506930,P78)
- 79.9.5 复合材料(Av44506930,P79)
- 80.9.6 液晶材料(Av44506930,P80)
- 81.10.1 氨基酸与蛋白质(Av44506930,P81)
- 82.10.2 酶与生物催化(Av44506930,P82)
- 83.10.3 核酸(Av44506930,P83)
- 84.10.4 糖类(Av44506930,P84)
- 85.10.5 脂类(Av44506930,P85)
- 86.10.6 微量元素与人体健康(Av44506930,P86)
- 87.10.7 食品安全(Av44506930,P87)
大学化学mooc(天津大学)
第1章物质结构基础
1.1原子结构及核外电子的排布
1、微观粒子的特性粒二象性运动的统计性

第2章化学反应的能量关系
2.1基本概念
系统与环境
状态—→标准状态
状态函数及性质——强度性质和容量性质状态变化—过程只确定于始态与终态,与途径无关
2.2热力学第一定理
1、内能U热力学能
系统内部的原子和分子的各种形式能量的总和。
包括:分子振动、转动能;分子内原子的作用能—键能;电子的能量;质子运动的平动能;核内粒子间的作用能——核能.
3、焙H大多数过程都伴有P,V变化,故定义:
H=U+PV同样焙是状态函数,无法获得绝对值,只需求焙变AH.
4、焙变AH的计算
焙变AH在数值上等与可逆过程的热效应AH=Q可标准生成热(焙),ArH9标准燃烧热(焙),△.He


第3章化学平衡和化学反应速率
3.1、化学平衡


3.2、化学反应速率
化学反应速率的表示——反应进度
影响化学反应速率的因素

第4章溶液
4.1单相离子平衡
1、稀溶液的通性(依数性)只取决于溶质的粒子数


3、溶度积规则——比较J与kOsp的大小
4、溶度积的应用
沉淀的生成、沉淀的溶解、沉淀的转化
4.3配位平衡
1.基本概念配合物的组成配合物的命名
2.配离子的离解平衡
第5章电化学基础
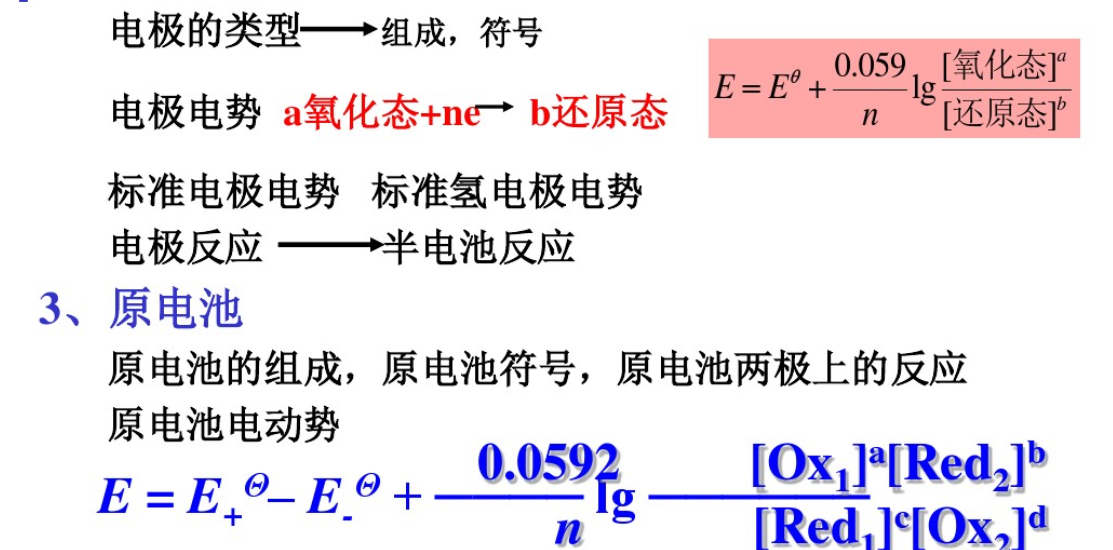
1、氧化数,氧化环原反应的配平,半反应,还原电对。
2、电极