- 催化原理-1-1
- 催化原理-1-2
- 催化原理-2-1
- 催化原理-2-2
- 催化原理-2-3
- 催化原理-2-4
- 催化原理-3-1
- 催化原理-3-2
- 催化原理-3-3
- 催化原理-3-4
- 催化原理-3-5
- 催化原理-3-6
- 催化原理-3-7
- 催化原理-4-1
- 催化原理-4-2
- 催化原理-4-3
- 催化原理-4-4
- 催化原理-4-5
- 催化原理-4-6
- 催化原理-4-7
- 催化原理-4-8
- 催化原理-4-9
- 催化原理-4-10
- 催化原理-4-11
- 催化原理-4-12
- 催化原理-4-13
- 催化原理-4-14
- 催化原理-4-15
- 催化原理-4-16
- 催化原理-4-17
- 催化原理-4-18
- 催化原理-4-19
- 催化原理-5-1
- 催化原理-5-2
- 催化原理-5-3
- 催化原理-5-4
- 催化原理-6-1
- 催化原理-6-2
- 催化原理-6-3
- 催化原理-7-1
- 催化原理-8-1
- 催化原理-8-2
- 催化原理-9-1
- 催化原理-9-2
- 催化原理-10-1
- 催化原理-9-3
- 催化原理-10-2
第一章绪论
授课内容
·引言
催化作用的意义,催化作用与热力学
·催化作用与催化剂的定义、概念
·催化剂的重要性质·催化剂的一般组成
·催化体系的分类·催化科学的发展·催化科学的范围
1.1引言
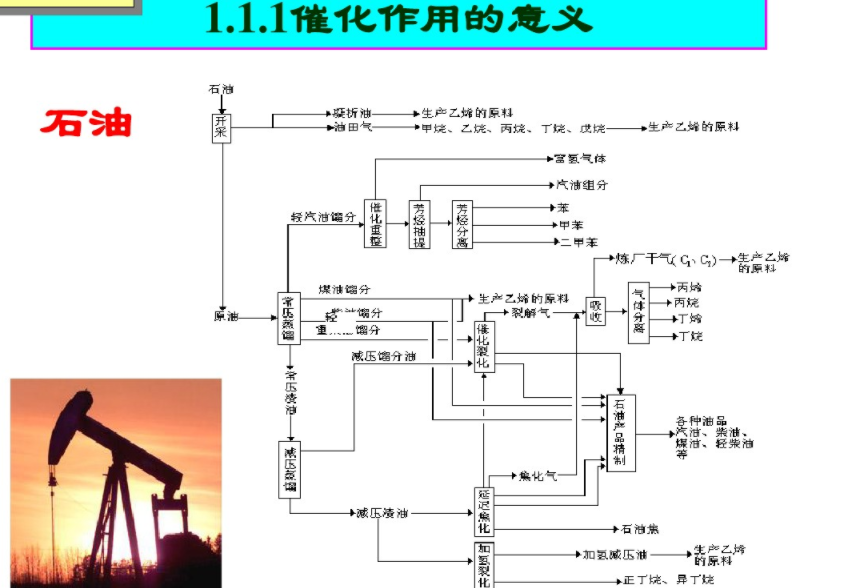
1.1.1催化作用的意义
1、催化剂在国计民生中的作用催化剂一现代化学工业的基石,现代化学工业的心脏
现代化学工业过程:
·据统计,现有90%以上的化工过程是采用催化剂进行生产的。借助于催化剂生产的产品总值在全世界工业生产总值中约占18%,仅低于机械产品的总值
·催化剂直接销音额~100亿美元/年
·催化剂消耗量>100万吨/年
·产生的产品价值>10000亿美元/年
1.1.1催化作用的意义
2、催化剂的应用领域
(1)合成氨及合成甲醇:产量最大的合成化学品
(2)石油炼制与合成燃料:运输量和消费量最大的化学品
(3)无机化学工业:酸、碱、盐,硫酸和硝酸的生产(4)基本有机合成工业:醇、醛(酮)、酸、酯、晴(5)三大合成材料:合成树脂与塑料、合成橡胶、合成纤维Ziegler-Natta、后过渡金属、茂金属催化剂(6)精细化工产品:品种最多、平均单价高的化学品(7)生物化工:最有潜力和发展前景的化工领城
(8)环境化学:与人类生存密切相关的领域,尾气净化
1.1.1催化作用的意义3、自然界
生物界:一切生命活动都商不开酶催化地质:地质催化,如:石油生成的催化作用日常生活:空气净化
1.1.2催化作用与热力学、动力学1、化学反应体系实现的2个基本要素
·热力学可行性:反应能否进行、进行的程度热力学平衡:化学反应的极限,反应的方向
·动力学可能性:反应进行的速度、何时达到平衡2者缺一不可
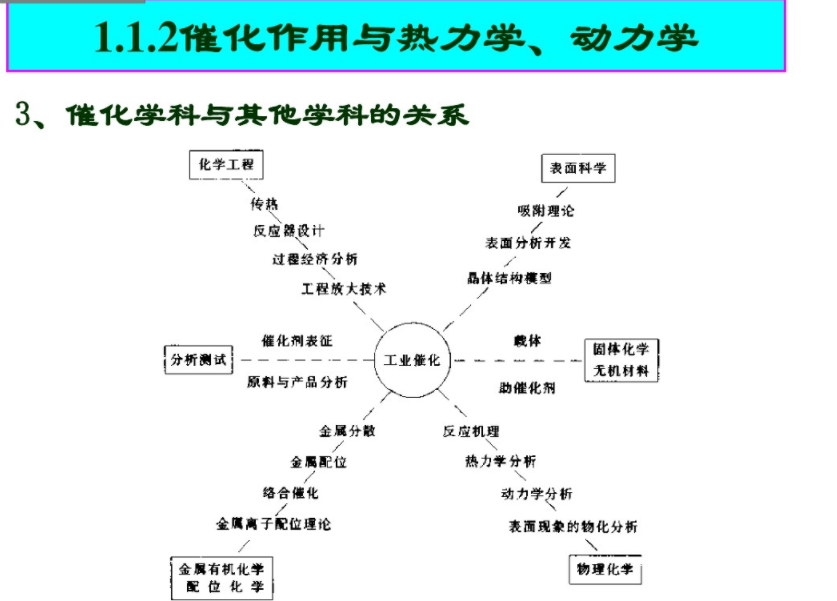
1.1.2催化作用与热力学、动力学2、催化剂的作用
(1)加快反应速度
催化剂能改变反应途径,降低反应活化能催化只能加快热力学可行的反应速度不能改变反应平衡常数
正反应和逆反应同样加速
只能加快热力学上可行的反应,“催化不是万能的”
(2)提高选择性
改变反应历程
降低反应活化能
加快主要反应速度
1.2催化作用与催化剂
1.2.1催化作用
1、催化作用早期的历史
·最早的催化一Biocatalysis:中国,公元前,发酵一酿酒、制醋、酱和酱油制做、侵头和面包制做等
·非生物催化
一1740年,英国,Ward,硝酸钾促进硫磺的燃烧反应一1781年,法国,Parmentier,硫酸促进淀粉水解一1816年,英国,Davy,铂促进甲婉和醇的氧化反应一1820年,视国,Dobereiner,铂粉促进氢气和氧气的化合(化学演示反应)特点:只是有意识地应用了催化作用,并不知道催化作用,并未提出“催化”
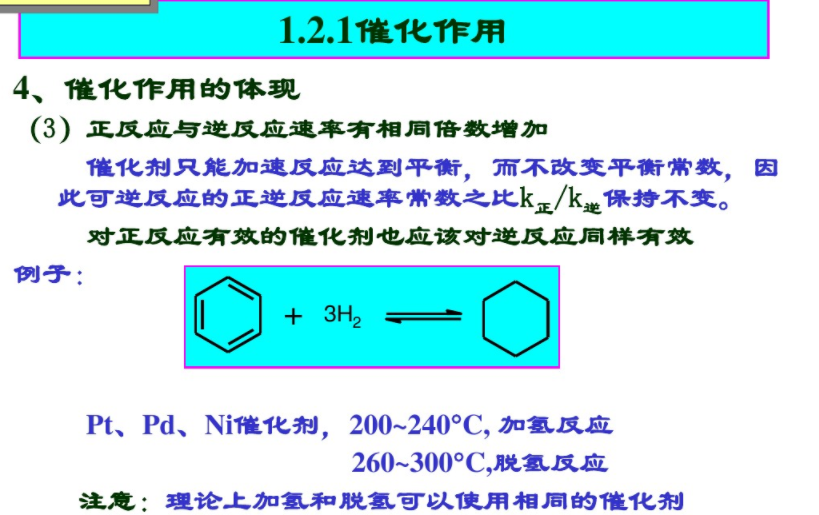
1.2.1催化作用4、催化作用的体现
(1)只加速热力学上可行的反应催化剂只能加速热力学可行的反应,而不能实现热力学不可能的反应。
(2)催化剂不影响平衡常数
反应终了时催化剂的化学性质没有改变,不会影响反应体系的标准自由能变化AG0,因而也不会影响平衡常数K。与此相反,若一种物质加入后使反应体系的AG0改变,则不能看作是催化剂。
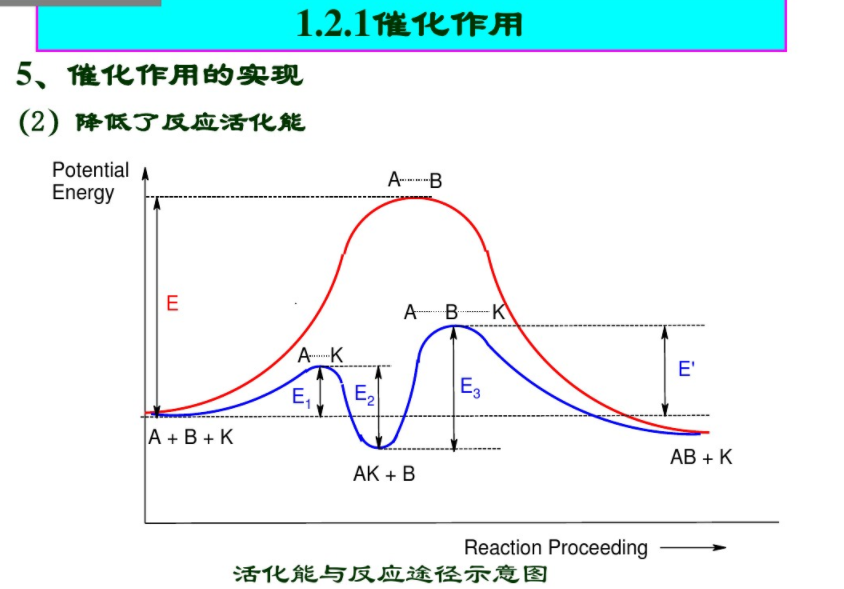
1.2.1催化作用
7、催化反应中的催化剂
(2)催化剂用量少且不消耗
催化剂在反应过程完成后并不消耗
少量催化剂可以催化大量反应物
特效催化剂:酶催化和有机金属催化催化剂浓度在10-6-9数量级(3)化学计量方程式与催化剂量无关,反应速度与催化剂量成正比
(4)参加反应后催化剂会有变化但很微小催化剂组成、结构和孔结构的缓慢变化催化剂与反应物和产物的元素交换
活性组份的微小变化
其他派生反应—一催化剂缓慢失活的原因
1.2.2催化剂的重要性质评价催化剂的四个最重要的性质(指标):
(1)活性,Activity,高(2)选择性,Selectivity,高(3)寿命,Lifetime,长(4)价格,Cost,低
1.2.2催化剂的重要性质
1、催化剂的活性
(1)活性的表示方法:活性高医表示催化剂对反应加速的强弱,表示催化剂活性的方法很多,通常有以下几种方法:
A)转换频率,turnover frequency/s-1:在给突反应条件及一定反应程度下,单位时间内每个活性位上发生的总包反应次数。这是催化活性的本质表示,非常科学。但由于催化活性位的组成、结构和数量难以确定,实际上难以实现,只限于理论研究
1.2.2催化剂的重要性质1、催化剂的活性
B)反应速率:反应速率表示反应的快慢,不同场合使用不同速率表示法。在多数情况下,以反应物消失的速率或以产物生成的速率表示反应的快慢。

1.2.2催化剂的重要性质1、催化剂的活性
·在气固多相催化反应使用固体催化剂情况下,Q可以是催化剂的体积(单位体积的反应速率,V)、质量(反应的比速率,m)或表面积(单位面积的反应速率,A)
·在均相催化时,Q是反应体系的体积
√用速率比较催化剂的活性时,应保证反应进行时的温度、压力和原料气的组成相同工业上常用时空收率表示催化剂的活性。其定义是每小时每升催化剂所得产物量。它是一段时间内速率的平均值。虽然这种表示活性的方法不精确,但较实用
1.2.2催化剂的重要性质
1、催化剂的活性
C)速率常数:用速率常数比较活性时,要求温度相同,在不同催化剂上反应,仅当反应的速率方程有相同的形式时,用速率常数比较活性大小才有意义
D)转化率:这也是常用的比较催化剂活性的参量。
转化率定义为:X=反应物转化量/引入体系的反应物总量*100%
在用转化速率比较活性时:要求反应温度,压力、原料气浓度和接触时间(停留时间)相同
·若为一级反应,由于转化率与反应物浓度无关,则不要求原料气浓度相同的条件